Europeiska PAH-riktlinjer rekommenderar prognostisk riskstratifiering vid PAH-diagnos och uppföljning för att vägleda behandling. Målet är att uppnå eller upprätthålla riskkategorin »låg risk«, som motsvarar en 1-årsmortalitet <5 procent.
En viktig orsak till låg användning av riskstratifieringsinstrument bland kliniker är tidsbrist. Implementering av tidsbesparande lösningar har rekommenderats för att öka användningen.
Via ett nyutvecklat internetbaserat riskstratifieringsverktyg (https://www.svefph.se/risk-stratification) kan individuell riskgrupp bestämmas och behandling styras, med förhoppningen att uppnå bättre följsamhet till ESC/ERS-riktlinjernas evidensbaserade rekommendationer.
Pulmonell arteriell hypertension (PAH) är en progressiv proliferativ lungkärlssjukdom som drabbar små artärer [1, 2]. PAH karakteriseras av såväl hemodynamiska förändringar, såsom ökat tryck i lungkretsloppet och förhöjt lungkärlsmotstånd, som strukturella kärlförändringar inklusive mediahypertrofi, oblitererande intimaförtjockning och fibros. Sammantaget kan dessa förändringar orsaka högersidig hjärtsvikt och tidig död [2].
PAH är ett sällsynt tillstånd: enligt epidemiologiska data från Svenska PAH-registret (SPAHR) är incidensen ca 8 fall/miljon invånare och år och prevalensen ca 49 fall/miljon invånare [3]. Detta innebär att ca 500 individer lever med sjukdomen i Sverige i dag [4]. Patofysiologin vid PAH är multifaktoriell och ofullständigt klarlagd, men en betydande del tillskrivs en obalans i endotelin-, prostacyklin- och kväveoxidsystemet, vilket resulterar i en kärlsammandragning. Detta utnyttjas vid behandling, som syftar till att vidga lungkärlen och avlasta högerhjärtat [2, 5]. Innan PAH-specifika läkemedel fanns tillgängliga var medianöverlevnaden 2,8 år från diagnos, och vid PAH associerad med reumatisk sjukdom endast ca 1 år [6]. I dag finns ett stort urval av godkända PAH-specifika läkemedel, som är aktiva via fyra administreringsvägar (intravenöst, subkutant, oralt och i inhalationsform) [5]. Dessa läkemedel förskrivs och underhålls via landets sju specialiserade centrum för pulmonell hypertension. I Sverige ligger medelöverlevnaden för PAH med PAH-specifik behandling mellan 4,3 och 5,8 år, beroende på underliggande sjukdom [3], och 5-årsöverlevnaden är ca 60 procent [3, 4].
Prognostisk riskstratifiering
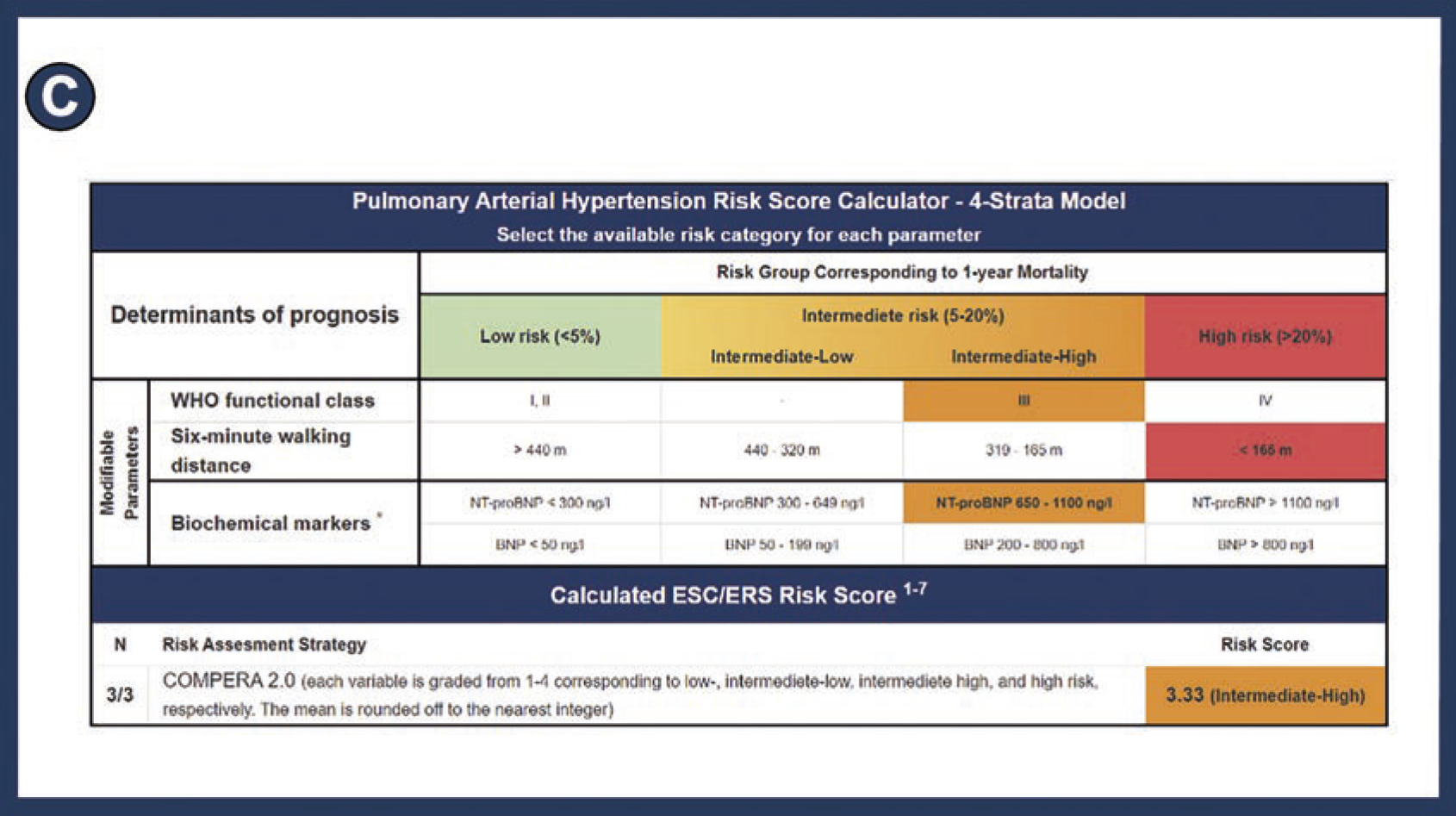
När PAH-diagnosen är fastställd och behandlingen inledd fortgår uppföljningen holistiskt med utgångspunkt från ett multidisciplinärt förhållningssätt inom universitetssjukhusens team för pulmonell hypertension, bestående av olika kompletterande yrkeskategorier. I de senaste riktlinjerna (2022) från de europeiska hjärt- och lungmedicinska sällskapen (European Society of Cardiology/European Respiratory Society, ESC/ERS) specificeras i behandlingsalgoritmen prognostisk riskstratifiering vid diagnos utifrån indelning av patientens riskprofil i tre kategorier (låg, intermediär eller hög risk), samt vid uppföljningar utifrån indelning i fyra kategorier (låg, låg intermediär, hög intermediär eller hög risk), för att vägleda behandling [7-9] (Figur 1). Syftet med behandlingen är att upprätthålla eller uppnå en lågriskprofil, motsvarande en 1-årsmortalitet <5 procent.
År 1991 publicerades den första studien som utarbetade en prognostisk ekvation för att estimera överlevnad hos patienter med PAH [6]. Därefter har ett antal validerade beräkningsinstrument för riskstratifiering utarbetats, inklusive SPAHR/Compera [10, 11], det franska registrets beräkningsmodell [12], Uppdaterad SPAHR [9, 13], Compera 2.0 [14], Reveal 2.0 [15] och Reveal 2.0 Lite [16]. Riskstratifieringsinstrumenten skiljer sig från varandra avseende antal parametrar, typ av parametrar (modifierbara eller icke modifierbara), mätta på ett invasivt eller icke-invasivt sätt och förekomst av viktning.
Riskstratifiering är kliniskt underutnyttjad
Trots flertalet validerade riskberäkningsinstrument är prognostisk riskstratifiering i dag underutnyttjad kliniskt [17-19]. En studie demonstrerade att klinisk riskskattning överrensstämmer endast i 45 procent av fallen med riskvärdering via validerade beräkningsinstrument [18]. Vidare visades att 8 av 10 patienter som uppskattats vara i lågriskkategorin enbart utifrån klinisk bedömning hade en högre beräknad risk för 1-årsmortalitet [18]. I två enkätstudier fann man att endast 6 av 10 kliniker använder validerade riskstratifieringsinstrument [17, 19]. Vidare fann man i denna kartläggning att den främsta orsaken som drev underutnyttjande av riskstratifiering var tidsbrist bland vårdpersonal [17, 20]. Därför föreslogs implementering av teknikbaserade och tidsbesparande lösningar, inklusive datorbaserade program samt integrering av riskstratifieringsinstrument i elektroniska journalsystem. Dessutom rekommenderades utbildningsprogram för att öka medvetenheten om den kliniska effekten av rutinmässig riskstratifiering vid PAH [17, 20].
I en studie från SPAHR har värdet av riskstratifiering belysts. Vid tidig uppföljning är 1-, 3-, och 5-årsöverlevnaden 100 procent, 98 procent respektive 89 procent för patienter som förblir i lågriskkategorin samt 98 procent, 96 procent respektive 96 procent för dem som uppnår lågriskkategorin. Vidare är överlevnaden signifikant bättre om ≥75 procent av riskstratifieringsparametrarna klassificeras inom lågriskkategorin vid tidig uppföljning [10].
Implementering av datorbaserad uppföljningsmodell
I vår studie, som nyligen publicerades i European Heart Journal Open, evaluerades ESC/ERS-riktlinjernas strategi för riskstratifiering. För att underlätta riskbedömning och därmed vägledning av behandling vid PAH utvecklades ett internetbaserat riskstratifieringsverktyg (https://www.svefph.se/risk-stratification) [9] (Figur 2). Webbplatsen innehåller beräkningsinstrumenten SPAHR/Compera, det franska registrets beräkningsmodell, uppdaterad SPAHR samt Compera 2.0. Ett arbete med att även inkludera de amerikanska beräkningsinstrumenten Reveal 2.0 och Reveal 2.0 Lite pågår. Riskstratifieringsverktyget har utvecklats från ett VBA-programmerat Excel-ark som varit i bruk sedan 2019 på Hemodynamic lab på Skånes universitetssjukhus Lund [10].
Ambitionen med verktyget är att underlätta riskbedömning, såväl nationellt vid universitetssjukhusens centrum för pulmonell hypertension som internationellt, för optimal och likvärdig vård baserad på senaste forskningsrön.
Ur ett långsiktigt perspektiv är vår förhoppning att kontinuerligt kunna vidareutveckla vårt internetbaserade riskstratifieringsverktyg i takt med förfining och validering av de olika beräkningsinstrumenten för riskstratifiering. Detta planeras för att ytterligare stimulera riskstratifiering och optimera behandlingen vid PAH i ett europeiskt och internationellt perspektiv, eftersom PAH är en kronisk sjukdom som lätt kan destabiliseras och som ännu inte har någon kurativ behandling.
Potentiella bindningar eller jävsförhållanden: Abdulla Ahmed och Salaheldin Ahmed har erhållit föreläsararvoden från Janssen Cilag AB samt Nordic Infucare. Göran Rådegran är eller har varit klinisk prövare i PAH-studier för Acceleron, Actelion Pharmaceuticals, Bayer Health Care, Glaxo Smith Kline, Janssen, MSD, Pfizer och United Therapeutics, samt i hjärttransplantationsstudier för Novartis, är eller har varit engagerad i rådgivande kommittéer för Acceleron, Actelion Pharmaceuticals, Bayer Health Care, Eli Lilly, Glaxo Smith Kline, Janssen Cilag AB, MSD, Orpha Care och Sanofi samt har erhållit föreläsararvoden från Actelion Pharmaceuticals, Bayer Health Care, Glaxo Smith Kline, Janssen Cilag AB, MSD, Orpha Care och Nordic Infucare.
Göran Rådegran är ordförande i Svensk förening för pulmonell hypertension (SveFPH), FESC (Fellow of the European Society of Cardiology), och taskforcemedlem i gruppen för utarbetande av 2022 års ESC/ERS riktlinjer för pulmonell hypertension.